全部商品分類
- 手術(shù)急救設(shè)備
- 無(wú)影燈 急救車 電動(dòng)手術(shù)臺(tái) 電動(dòng)吸引器 擔(dān)架 手術(shù)套車 吸痰器 麻醉機(jī) 電動(dòng)呼吸機(jī) 嬰兒培養(yǎng)箱 注射泵 電動(dòng)牽引床 輸液泵 電動(dòng)洗胃機(jī) 負(fù)壓調(diào)整器 腳踏吸引器 手術(shù)導(dǎo)航系統(tǒng) 化療泵 排痰機(jī) 心肺復(fù)蘇器
- 手術(shù)器械
- 綜合組織剪 止血鉗 手術(shù)剪 子宮拉鉤 組織剪 手術(shù)刀 持針鉗 甲狀腺自動(dòng)拉鉤 鼻咬切鉗 器械鉗 鼻刀 鼻取樣鉗 鼻息肉鉗 鼻中隔咬骨鉗 鼻粘膜刀 醫(yī)用手術(shù)陰道擴(kuò)張器 扁桃體止血鉗 敷料鑷 牙齦刀 鼻中隔旋轉(zhuǎn)刀 布帕鉗 鼻咬骨鉗 鼻組織剪 婦產(chǎn)科器械包 拆線剪 技工鉗 光學(xué)鉗 鼻篩骨鉗 鼻異物鉗 外科器械包 顯微鑷 眼科鑷 金冠剪 耳刀 解剖剪 紗布繃帶剪 顯微喉刀 截?cái)嗟?/a> 牙齦剪 手術(shù)刀柄 分離結(jié)扎鉗 人流吸引管 眼科手術(shù)器械包 喉鉗 鼻粘膜鉗
- 培養(yǎng)箱
- 恒溫培養(yǎng)箱 生化培養(yǎng)箱 霉菌培養(yǎng)箱 光照培養(yǎng)箱 隔水式培養(yǎng)箱 恒溫恒濕箱 低溫培養(yǎng)箱 恒溫干燥箱 震蕩培養(yǎng)箱 空氣消毒箱 氣候培養(yǎng)箱 二氧化碳培養(yǎng)箱 厭氧培養(yǎng)箱 搖床培養(yǎng)箱 電熱恒溫培養(yǎng)箱

 吸引器
吸引器 高頻電刀
高頻電刀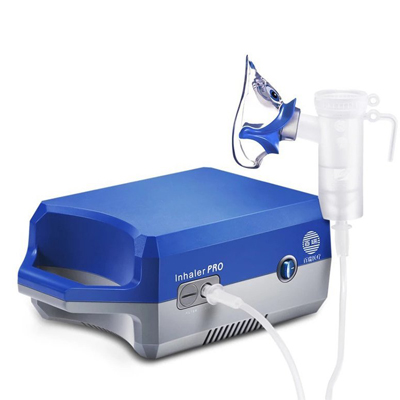 霧化器
霧化器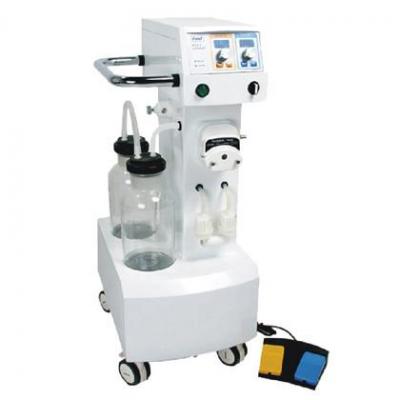 吸脂機(jī)
吸脂機(jī) 洗胃機(jī)
洗胃機(jī)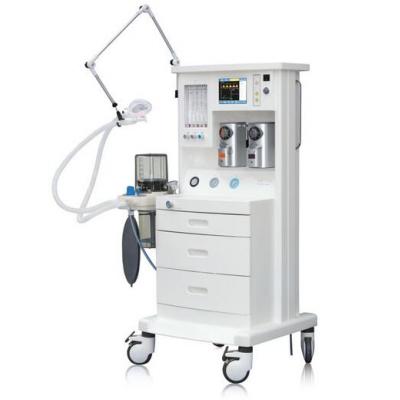 麻醉機(jī)
麻醉機(jī)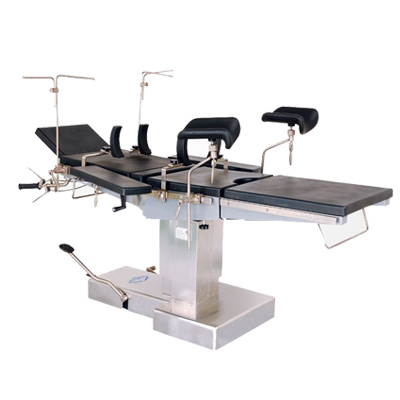 手術(shù)臺(tái)
手術(shù)臺(tái) 無(wú)影燈
無(wú)影燈
 400-006-1850
400-006-1850 滬公網(wǎng)安備 31011502008791號(hào)
滬公網(wǎng)安備 31011502008791號(hào)